Наследственные Болезни Обмена Веществ Руководство
Лаборатория наследственных болезней обмена веществ была создана в Медико-генетическом научном Центре более 25 лет назад. Первые работы в лаборатории были связаны с созданием тестов для выявления фенилкетонурии и программ селективного скрининга на некоторые из наследственных болезней. Постепенно лаборатория перешла к применению сложных биохимических и молекулярно-генетических методов точной диагностики наследственных заболеваний.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ АМУРСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ КАФЕДРА ДЕТСКИХ БОЛЕЗНЕЙ ЛЕЧЕБНОГО ФАКУЛЬТЕТА Э.Л. ЧУПАК, А.Ф. БАБЦЕВА НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ ОБМЕНА ВЕЩЕСТВ учебное пособие для студентов лечебного и педиатрического факультетов, ординаторов, интернов г. Благовещенск, 2012 УДК 616 – 056.76 – 053 Чупак Э.Л., Бабцева А.Ф. Наследственные болезни обмена веществ: учебное пособие, Благовещенск: Буквица, 2012. – 31 с. Рецензент: асс. кафедры детских болезней Амурской ГМА к.м.н. Юткина О .С . Наследственные болезни обмена веществ – один из обширных классов наследственных моногенных заболеваний человека. Данное пособие раскрывает вопросы этиопатогенеза, диагностики, профилактики и лечения наиболее распространенных наследственных болезней обмена. Одна из сложных задач врача – клинициста – заподозрить у больного нарушения из этой группы заболеваний и направить его на дополнительное биохимическое обследование. При ряде заболеваний ранняя диагностика дает возможность применять эффективные методы лечения. Рекомендуется для студентов лечебного и педиатрического факультетов, ординаторов, интернов. Печатается по решению ЦМК №3, ЦКМС Амурской ГМА, 2012. © ГБОУ ВПО Амурская ГМА Минздрава РФ © Чупак Э.Л., Бабцева А.Ф. Список сокращений ДНК – дезоксирибонуклеиновая кислота РНК – рибонуклеиновая кислота НБО – наследственные болезни обмена МПС – мукополисахаридоз БДЦМ – болезни дыхательной цепи митохондрий МБ – митохондриальные болезни 2 Число известных наследственных болезней и синдромов в настоящее время оценивается в 4500 (ОМIМ, 2007). Предполагается, что расшифровка генома и идентификация новых генов не сильно отразятся на этой величине, хотя и приведут к уточнению генов - кандидатов, ответственных за конкретные наследственные заболевания, а также генов – модификаторов, наличие которых в том или ином аллельном варианте может существенно влиять на фенотипические особенности болезни. Наследственные болезни обмена веществ – это моногенно наследующиеся заболевания, обусловленные мутациями генов, под контролем которых осуществляется синтез полипептидов (белков), выполняющих различные функции (структурные, иммунной защиты, ферментного катализа, транспортные). Известно, что разнообразные процессы хранения, реализации и воспроизведения генетической информации обеспечивают нуклеиновые кислоты: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК). Нуклеиновые кислоты – это полимеры, мономерами которых являются нуклеотиды. Нуклеотид включает в себя азотистое основание, углевод пентозу и остаток фосфорной кислоты. Азотистые основания нуклеотидов делятся на 2 типа: пуриновые (аденин и гуанин) и пиримидиновые (тимин, цитозин, урацил). Именно азотистые основания определяют уникальную структуру молекул ДНК и РНК. Местом хранения генетической информации организмов является ДНК. В 1953 году Дж. Уотсон и Ф. Крик предложили модель ее структуры, согласно которой молекула ДНК состоит из двух полинуклеотидных цепей, спирально закрученных одна относительно другой. Две нуклеотидные цепочки объединяются в единую молекулу ДНК при помощи водородных связей между азотистыми основаниями нуклеотидов разных цепей. Соединены азотистые основания по принципу комплиментарности: А – Т, Г – Ц. В основе воспроизведения себе подобных живыми организмами лежит процесс удвоения молекул ДНК (репликация). Рибонуклеиновая кислота (РНК) состоит из одной полинуклеотидной цепочки. В нуклеотидах РНК имеются 4 типа азотистых оснований: А, Г, Ц, У (урацил). Основные виды РНК в клетке: - Информационная (матричная) РНК – переносит информацию о структуре белка с ДНК на рибосомы (место непосредственного синтеза полипептидной цепи). У человека каждый белок клетки кодируется отдельной молекулой и – РНК. Молекула и – РНК представляет собой незамкнутую цепочку. - Рибосомальная РНК – р-РНК входит в состав рибосом, принимает непосредственное участие в синтезе полипептидной цепи. - Транспортная РНК – т-РНК переносит аминокислоты к месту синтеза белков на рибосомы. Специфичность т-РНК определяется структурой антикодона, т.е. участка соединения с определенным триплетом нуклеотидов и-РНК. Каждый антикодон определяет способность связываться с определенной аминокислотой на другом конце т-РНК. 3 Генетический материал человека сконцентрирован в ядре и представлен хромосомами, в которых молекула ДНК образует сложный комплекс с белками. Совокупность хромосом клетки называется кариотипом. У человека в кариотипе 46 хромосом (44 аутосомы и 2 половые хромосомы – у женщин ХХ, у мужчин ХY). В кариотипе соматических клеток выделяются пары одинаковых (по форме и генному составу) хромосом (гомологичные хромосомы): 1-я – материнская, 2-я – отцовская. Набор хромосом, содержащий пары гомологов, называется диплоидным. Гаметы (половые клетки), содержат половину диплоидного набора, по одной хромосоме из каждой пары гомологов (гаплоидный набор). Каждая хромосома состоит из двух идентичных хроматид и максимально спирализована. Соединяются хроматиды в области центромеры. Концевые участки хромосом называются теломерами. Они препятствуют слипанию хромосом. С каждым новым делением клетки теряется участок теломеры. Потеря всей теломеры приводит к смерти клетки. Участок хроматиды между центромерой и теломерой называется плечом. Плечи обозначаются: короткое – р и длинное - q . В зависимости от расположения центромеры различают следующие типы хромосом: - метацентрические (р = q); - субметацентрические (q > р); - акроцентрические (одноплечие – q). Кроме этого, существуют клеточные структуры, обладающие собственной генетической информацией – митохондрии, которые имеют кольцевые митохондриальные ДНК (мт – ДНК) в количестве 3 – 10 копий. В митохондриях человека содержится всего 37 генов, в которых отсутствуют интроны (некодирующие участки ДНК): 132 генов кодируют отдельные субъединицы комплексов дыхательной цепи митохондрий и 24 гена обеспечивают трансляцию белка на митохондриальных рибосомах. Суть хромосомной теории наследственности (Т. Морган и его школа) состоит в следующем: 1. Гены располагаются в хромосомах в линейной последовательности. 2. Каждая хромосома представляет группу сцепления генов. 3. Каждый ген занимает в хромосоме определенное место – локус. Локус – это участок расположения гена на хромосоме. Хромосомы содержат последовательности генных локусов, причем у гомологичных хромосом эти последовательности одинаковые. Гены, расположенные на одной хромосоме, являются сцепленными. Однако сцепление не является абсолютным. В результате кроссинговера сцепленные гены могут быть разъединены и при мейотическом делении они оказываются в разных гаметах. Для характеристики проявления генов в фенотипе используются специальные термины: Пенетрантность – проявляемость гена в фенотипе. Экспрессивность – степень выраженности признака в фенотипе. Генотип – это система взаимодействующих генов, а фенотип – результат взаимодействия генов в конкретных условиях внешней среды. 4 Генетический полиморфизм (ГП) – генетическая вариабельность в пределах одного вида (Homo sapiens). ГП не нарушают экспрессию генов, но приводят к появлению белков с измененными физико – химическими свойствами (например: изоферменты). Разница между мутациями и ГП весьма относительна. Мутации – это наследственные изменения генетического материала. Большая часть мутаций приводит к различным нарушениям нормального развития, некоторые из них летальны. Мутагенные факторы (оказывают повреждающее действие на ДНК): 1. Физические: ионизирующее излучение, воздействие которого помимо первичного повреждения ДНК, образует в клетке свободные радикалы, способные вторично вызывать изменения генов, УФ – излучение и др.; 2. Химические (различные соединения); 3. Биологические (вирусы, мобильные генетические элементы, некоторые ферменты). Генные мутации представляют собой изменения нуклеотидного состава ДНК отдельных генов. Мутации могут происходить в одной точке либо в нескольких разных точках. Определяют два основных процесса формирования генных мутаций: 1. Замена одного нуклеотида на другой в смысловой части гена (экзоне): транзиции (месторасположение пуриновых и пиримидиновых нуклеотидов сохраняется), трансверсии (пуриновые и пиримидиновые нуклеотиды меняются местами). Точечные замены в кодирующих последовательностях ДНК могут быть причиной различных мутаций, тип которых полностью определяется природой нуклеиновой замены, то есть тем, каким становится трехбуквенный код (кодон) нуклеиновой последовательности ДНК после замены. Так, в случае нонсенс мутации замена нуклеотида в кодирующей части гена приводит к образованию стоп – кодона – триплета, на котором прекращается трансляция и, соответственно, синтез белка на рибосомах. В случае миссенс мутации возникает триплет, соответствующий кодону другой аминокислоты, которая и оказывается включенной в полипептидную цепь мутантного белка. 2. Сдвиг рамки считывания: инсерция (вставка одного или нескольких нуклеотидов), делеция (утеря одного или нескольких нуклеотидов). Это приводит к остановке трансляции. 3. «Динамические» мутации – спонтанные изменения числа тандемных повторов из одного и более нуклеотидов в транскрибируемой части гена. Нарастание триплетов ведет к синтезу пептидов с необычно длинными монотонными трактами одной аминокислоты, например, глютаминовой, в случае хореи Гентингтона, либо нарушается функция генов с дефицитом белков (синдром ломкой Х – хромосомы). Эти альтерации происходят во время репликации (удвоения) ДНК при подготовке клетки к делению. Хотя процесс репликации чрезвычайно точный и существует сложная система ферментов узнавания и исправления ошибок репликации (репарации), тем не менее, такие ошибки встречаются в среднем с частотой 10-9 – 10-11 на один включенный нуклеотид. 5 Мутации могут быть функционально молчащими, если они не затрагивают структуру самого гена или приводят к таким заменам нуклеотидов, при которых в конечном полипептиде сохраняется та же аминокислота. Поскольку каждая аминокислота кодируется несколькими разными триплетами (3 последовательных нуклеотида), то замена одного из трех нуклеотидов в кодоне не всегда приводит к замене аминокислоты в белке. Мутации выключают работу гена, ведут к значительному снижению синтеза его белкового продукта («минус эффект») или к его избытку («плюс эффект»), или к появлению аномального белка, следствием чего являются моногенные болезни. Около 10 – 20 % представителей белой расы Западной Европы и 2 % жителей России являются гетерозиготными носителям мутаций гена муковисцидоза (мутация delF508). Согласно последним данным по расшифровке молекулярной структуры 1 – й пары хромосом человека, в ней находится 3141 ген, 950 псевдогенов (гены, утратившие вследствие мутаций способность к экспрессии). С этой хромосомой связывают свыше 350 наследственных заболеваний и многие злокачественные образования. Число генов на Х – хромосоме оценивается в 1098, из которых 99 контролируют репродуктивную функцию или ассоциированы с раком. Общая характеристика моногенных наследственных болезней обмена: 1. Носят врожденный характер; 2. Манифестируют в любом возрасте; 3. Проявляются определенной, часто прогрессирующей клинической симптоматикой; 4. Сопровождаются грубыми нарушениями жизнедеятельности человека; 5. Сопровождаются различной степенью умственной отсталости; 6. Подлежат трудоемкому и дорогостоящему лечению; 7. Имеют высокий закономерный риск передачи потомству; 8. В случаях точной диагностики и наличия подробной информации о типе мутации и ее доклинических (биохимических) проявлениях подлежат дородовой диагностике; 9. В случаях разработки эффективной терапии подлежат доклиническому выявлению и лечению. Биохимическая классификация НБО: 1. Болезни обмена аминокислот; 2. Болезни углеводного обмена; 3. Болезни обмена органических кислот; 4. Болезни обмена жирных кислот; 5. Болезни обмена пуринов и пиримидинов; 6. Болезни обмена холестерина; 7. Болезни обмена гема и порфиринов; 8. Болезни обмена металлов; 9. Болезни обмена витаминов; 6 10. Болезни клеточных органелл: лизосомные, пероксисомные, митохондриальные; 11. Нарушения цикла мочевины; Клиническая классификация НБО Группа НБО Примеры заболеваний Нарушения синтеза и Симптомы постоянные, Лизосомные, распада прогрессирующие, не зависят пероксисомные биомакромолекул от интеркуррентных болезни заболеваний и не связаны с особенностями питания Болезни интоксикационного типа Острая интоксикация: Нарушения обмена рвота, летаргия, кома, аминокислот, печеночная недостаточность, органических тромбоэмболия кислот, цикла Хроническая мочевины интоксикация: прогрессирующая ЗПМР, кардиомиопатия Ацидоз, кетоз, гипогликемия, гипераммониемия и т. д. Мышечная гипотония, кардиомиопатия, ЗПМР, жировая дистрофия печени Лактатацидоз, гипогликемия Митохондриальные болезни, болезни обмена жирных кислот, гликогенозы Клинические особенности Нарушения образования и утилизации энергии Наследование НБО: 1. Аутосомно-рецессивный тип наследования; 2. Аутосомно-доминантный тип наследования; 3. Х-сцепленный рецессивный тип наследования (МПС II (б-нь Хантера), бнь Фабри, адренолейкодистрофия); 4. Митохондриальное (материнское) наследование. Варианты клинической манифестации НБО: 1. Острые тяжелые расстройства в неонатальном периоде; 2. Поздно появляющиеся острые или повторяющиеся симптомы; 3. Хронические прогрессирующие системные нарушения; 4. Специфические постоянные признаки, указывающие на определенные нозологические формы. 7 Органические амоноацидопатии, органические ацидурии, органические ацидемии – группа заболеваний, которые характеризуются повышенной экскрецией органических кислот с мочой, большинство которых возникает в результате нарушений определенных стадий обмена аминокислот. К ним относятся: злокачественная гиперфенилаланинемия, тирозинемия, болезнь «кленового сиропа» мочи, гиперлейцин – изолейцинемия, изовалериановая ацидемия (болезнь «потных ног»), гомоцистинурия. Это наиболее изученная группа генетически детерминированных ферментопатий. Для классических ранних форм ОА характерно острое начало с развитием симптомов метаболической декомпенсации: нарушение вскармливания, рвота, нарушение сознания, эпилептические приступы, изменение мышечного тонуса. Для ОА с поздней манифестацией характерно нарушение психоречевого развития, атаксия, очаговые неврологические симптомы, синдром Рейе, повторные пароксизмы необъяснимого кетоацидоза, психиатрические расстройства. Выявление у ребенка тяжелого метаболического ацидоза в первые дни жизни позволяет заподозрить заболевания из группы ОА. Характеристика метаболического ацидоза. Кислотно – щелочное равновесие – поддержание в определенных пределах постоянства водородного показателя (рН) внутренней среды организма. Характеризуется кислотно – основное состояние тремя основными показателями: рН, Рсо2 (парциальное давление СО2), содержание гидрокарбонатов (гидрокарбонаты НСО3, избыток оснований ВЕ, буферные основания ВВ). рН плазмы отражает концентрацию гидроводородных ионов и поддерживается в узких пределах от 7,35 до 7,45. Обменные процессы сопровождаются выработкой или поглощением Н+, в результате чего снижается (ацидемия) или повышается (алкалемия) рН. Изменения рН предотвращаются буферными системами, которые временно фиксируют избыток Н+, а затем он выделяется почками. Причиной метаболического (обменного) ацидоза при ОА является повышенное образование Н+ в результате накопления кетоновых тел в крови при усиленном катаболизме белка и накоплении в биологических жидкостях и тканях АМК и их производных. В тех случаях, когда продукция кислот превышает возможности почек выводить их, уменьшается содержание гидрокарбонатов в крови, а затем снижается и рН. Злокачественная гиперфенилаланинемия (фенилкетонурия) Этиология и патогенез: Мутации в структурных генах цитозольных ферментов: •дигидроптеридинредуктазы (ген картирован на 4р15.31); •гуанозинтрифосфат – циклогидролазы (ген не картирован); •6 – пирувоилтетрагидроптерин синтазы (ген картирован на 11q22.3 – q23.3) приводят к недостаточности этих ферментов в лейкоцитах, лимфоцитах, эритроцитах, тромбоцитах, печени. В свою очередь недостаточность фермента 8 блокирует синтез тетрагидробиоптерина, что ведет к нарушению функции гидроксилаз ароматических аминокислот (фенилаланин, тирозин, триптофана) и, следовательно, к нарушению процесса гидроксилирования фенилаланина в печени, тирозина – в головном мозге и надпочечниках, триптофана – в головном мозге, недостаточности нейротрансмиттеров (ДОФА, серотонин, норэпинефрин), торможению синаптической передачи возбуждения, накоплению в биологических жидкостях и тканях ароматических АМК и их производных (фенилпировиноградная кислота, фенилуксусная кислота), многие из которых токсичны для ЦНС. В головном мозге наблюдаются процессы демиелинизации и глиоза. Выделяют 3 формы злокачественной гиперфенилаланинемии (в зависимости от недостаточности соответствующего фермента), которые имеют схожее клиническое течение. Клинические признаки: • в периоде новорожденности, либо на первом году жизни появляются нарушение вскармливания за счет дисфагии, вялость, гипотрофия, отставание роста, гипервозбудимость, судороги, снижение моторной активности, задержка двигательного развития с прогрессирующим отставанием психики. Часты эпилептиформные припадки: развернутые судорожные и бессудорожные типы кивков, поклонов, вздрагиваний, кратковременных отключений сознания; • в раннем возрасте выявляется мышечная гипотония, которая сменяется мышечной гипертонией, приводящей к своеобразной «позе портного» (поджатые ноги и согнутые руки), отмечаются гиперкинезы, тремор пальцев рук, атаксия, центральные парезы; • дети часто белокурые, со светлой кожей и голубыми глазами; • отмечаются дерматиты, экзема, повышенная потливость с характерным мышиным запахом; Смерть в возрасте до 3 лет от интеркуррентных инфекций и тяжелой энцефалопатии. Материнская ФКУ 1. Болезнь представляет собой эмбриофетопатию: синдром умственной отсталости и врожденных аномалий как результат действия на плод высокого уровня фенилаланина в крови матери, которая страдает фенилкетонурией; 2. У детей отмечается умственная отсталость, врожденная гидроцефалия, низкая масса тела при рождении, гипоплазия отдельных регионов мозга, пороки сердца и других органов, микроаномалии развития; 3. Тяжесть клинических проявлений зависит от степени увеличения содержания ФА в крови у матери во время беременности. Диагностика: 1. Повышение уровня фелиаланина в плазме; 9 2. 3. 4. 5. Снижение активности дигидроптеридинредуктазы в лейкоцитах, эритроцитах, фибробластах; Снижение содержания неоптерина и биоптерина в моче; Нагрузочный тест с фенилаланином (180 мг/кг) – не увеличивается уровень биоптерина в сыворотке; Нагрузочный тест с тетрагидробиоптерином (7, - 20 мг/кг) per os и внутривенно – ведет к нормализации плазменного фенилаланина через 4 – 8 часов. Лечение Лечение должно быть начато не позднее 3 – недельного возраста жизни ребенка. Диета, при которой необходимо исключить избыточное поступление в организм ребенка АМК фенилаланин, источником которого является белковая пища. Используются смеси, не содержащие ФА: МDмил ФКУ – 0, Лофеналак, Афенилак, АпонтиФКУ40. Назначение на 1 – м месяце жизни (сразу после постановки диагноза): 1. Тетрагидробиоптерин 2 – 20 мг/кг/день per os; 2. L – ДОФА 10 – 15 мг/кг/день: 3. КарбиДОФА 0,5 – 1,5 мг/кг/день; 4. 5 – гидрокситриптофан 3 – 5 мг/кг/день; 5. Фолиевая кислота 10 мг/день. При своевременно установленном диагнозе и назначении лечения прогноз в плане жизнеспособности благоприятный, хотя сохранность интеллекта и отсутствие неврологической симптоматики достигается не у всех. Профилактика Пренатальная диагностика возможна путем определения активности дигидроптеридинредуктазы в культуре амниоцитов, методами ДНК – диагностики;Массовый скрининг новорожденных (доклиническая диагностика ФКУ) – проведение первичного и повторного исследования (ретест) уровня ФА в образце крови новорожденного в условиях регионального медико – генетического центра, куда доставляется материал из родильных домов или детских стационаров и поликлиник. I этап массового неонатального скрининга: если уровень ФА выше 2 мг% требуется обследование на II этапе. II этап массового неонатального скрининга: если уровень ФА 2 – 6 мг% гиперфенилаланинемия, требуется ограничение потребляемого белка и динамический контроль ФА в крови, лечебные смеси не показаны, если уровень ФА выше 6 мг% - ФКУ, необходима жесткая диета с использованием лечебных смесей аминокислот лишенных ФА, под контролем уровня ФА в крови. Тирозинемия (тирозиноз, гепаторенальная тирозинемия) 10 Этиология и патогенез: Мутации в структурном гене цитозольного фермента фумарилацетоацетат – гидролазы (катализирует последнюю реакцию катаболизма тирозина – гидролиз фумарилацетоацетата на фумаровую и ацетоуксусную кислоты) приводят к ее недостаточности в печени, почках, лимфоцитах. Ген картирован на 15q23-q25. Недостаточность фермента ведет к внутриклеточному накоплению гепато и реналотоксичных фумарилацетоацетата и малеилацетоацетата, что и обусловливает патологические изменения печени и почек: микронодулярный (представлен при рождении) цирроз, прогрессирующий в макронодулярный цирроз, диспластические изменения, прогрессирующие в гепатоцеллюлярную карциному, гломерулосклероз и ультраструктурные изменения канальцев, характерные для синдрома Фанкони. Клиническая картина. Острая форма: Развивается в неонатальный период или в первые недели/месяцы жизни, характеризуется: 1. Отмечается рвота, диарея, дегидратация, задержка физического развития, отставание в росте, гипотрофия, лихорадка, мышечная гипотония, затянувшаяся желтуха, специфический запах тела по типу «вареного капустного листа», гепатомегалия, гепатоспленомегалия, редко – асцит; 2. Часто заболевание манифестируем возникновением острых печеночных кризов, когда на фоне фебрильной температуры остро развивается асцит, желтуха, абдоминальные боли, кровотечения в области желудочно – кишечного тракта; 3. Смерть наступает в возрасте до 1 года от печеночной недостаточности или кровотечения. Хроническая форма: Развивается на первом году жизни, имеет более мягкое хроническое течение, характеризуется: 1. Печеночные кризы, хроническая печеночная недостаточность с гепатомегалией или гепатоспленомегалией; 2. Почечно – тубулярная дисфункция с нефромегалией; 3. Рахит со специфическими изменениями скелета; 4. Гипертрофическая обструктивная кардиомиопатия, артериальная гипертензия; 5. Неврологические кризы – приступы периферической полинейропатии: в острую фазу развиваются болезненные парестезии, артериальная гипертензия, тахикардия, паралитическая непроходимость кишечника, прогрессирующие параличи, длительностью 1 – 7 дней, после чего наступает период восстановления; 6. Возникновение аденоматоза и гепатокарциномы у детей старше 2 лет. 11 7. Смерть наступает в возрасте 3 – 10 лет от печеночной недостаточности, кровотечений, карциномы печени, неврологических кризов. Диагностика: 1. Снижение активности фумарилацетоацетат – гидролазы в лимфоцитах, эритроцитах, биоптате печени; 2. Повышение уровня тирозина, сукцинилацетона в моче и крови. Лечение 1. Низкобелковая диета (1,8 – 2,4 г белка/кг в сутки для детей 4 – 5 месяцев и 1 г белка/кг в сутки для детей старшего возраста). Назначение специальных сбалансированных смесей незаменимых и заменимых АМК, углеводов, жиров, витаминов, минеральных веществ, микроэлементов, не содержащих тирозин и фенилаланин. В России зарегистрировано несколько продуктов для диетического питания детей разного возраста (XPHEN TYR Тирозидон, XPHEN TYR – Аналог; ХРТМ – Аналог (компания «Нутриция») 2. Назначение препарата Орфадин, который ингибирует фермент 4 – гидроксифенилпируватдиоксигеназу, что предотвращает образование сукцинилацетона. Данный вид лечения приводит к улучшению функции печени, почек, предотвращает развитие неврологических кризов. При раннем назначении препарата снижается риск возникновения гепатокарциномы. 3. Трансплантация печени, гемодиализ. Профилактика: Пренатальная диагностика путем определения активности фумарилацетоацетатгидролазы в культуре амниоцитов, биоптате хориона; определения сукцинилацетона в амниотической жидкости. Болезнь «кленового сиропа» мочи (лейциноз) Этиология и патогенез: Мутации структурных генов для компонентов митохондриального мультиферментного дегидрогеназного комплекса α – кетокислот с боковыми цепями приводит к их недостаточности в печени, мышцах, миокарде, почках, жировой ткани. Кетокислоты транспортируются в митохондрии, где функционирует мультиферментный дегидрогеназный комплекс. Недостаточность его компонентов приводит к нарушению окислительного декарбоксилирования α – кетокислот с боковыми цепями (α-кето-β-метилвалериановой, αкетоизокапроновой, α-кетоизовалериановой) и их накоплению в биологических жидкостях и тканях в сочетании с аминокислотами, производными которых они 12 являются (лейцина, изолейцина, валина). Что в свою очередь приводит к метаболическому кетоацидозу, гипераммониемии, токсически действует на ЦНС, вызывая генерализованный или локальный (белое вещество мозжечка, ствол мозга) отек головного мозга, гипомиелинизацию и атрофию. Лейцин и его кетокислота имеют безусловный нейротоксический эффект, тогда как нейротоксическое действие валина и его кетокислоты сомнительно. Запах «кленового сиропа» обусловлен накоплением α-кето-β-метилвалериановой кислоты. Клиника: Клинический фенотип гетерогенен. Различают 4 формы: Классическая форма – острое течение заболевания. 1. Острое начало в первые дни жизни в виде отказа от пищи, симптомов неонатальной энцефалопатии (апатия, плаксивость, рвота, судороги, летаргия, кома) как реакции на белковую пищу на фоне метаболического кетоацидоза и гипогликемии. Неврологическая симптоматика прогрессирует. 2. Заболевание может начаться с внезапно развившегося апноэ (синдром «внезапной смерти младенца») или комы, вследствие угнетения ЦНС. 3. Запах «кленового сиропа» (напоминает запах карамели и солода) исходит от мочи или ушной серы. Промежуточная форма – хроническое течение заболевания без приступов острой метаболической декомпенсации, характеризуется: 1. Возраст начала болезни – до 7 лет; 2. Задержка психомоторного развития, судороги, умственная отсталость, частая рвота, приступы кетоацидоза или хронический мягкий метаболический ацидоз, легко купируемый диетой с низким содержанием белка, мышечная гипотония; 3. Запах «кленового сиропа» мочи, пота, серной пробки. Интермиттирующая форма – волнообразное течение, характеризуется: 1. Манифестирует в возрасте от 5 месяцев до 2 лет, иногда – после 40 лет приступами рвоты, дегидратации, прогрессирующей летаргией, судорогами, мозжечковой атаксией. В межприступный период пациенты жалоб не предъявляют, биохимические показатели могут быть в пределах нормы; 2. Приступы метаболического кетоацидоза провоцируются вакцинацией, интеркуррентными инфекциями, высокобелковой диетой, оперативными вмешательствами. На высоте приступа метаболического кетоацидоза может развиться ступор или кома с летальным исходом; 3. Запах «кленового сиропа» мочи, пота, серной пробки. Тиамин – зависимая форма выделяется условно из – за отсутствия четких диагностических критериев. 1. Клиническое течение сходно с таковым при промежуточной форме, но характеризуется частичным или полным купированием клинико – 13 биохимической симптоматики при назначении тиамина и диеты с низким содержанием белка. Диагностика 1. Снижение активности дегидрогеназы α-кетокислот с боковыми цепями в лейкоцитах, культуре кожных фибробластов; 2. Повышение концентрации лейцина, изолейцина, валина в крови и моче (методом высокоэффективной жидкостной хроматографии или тандемной масс – спектрометрии); 3. Повышение уровня кетокислот: α-кето-β-метилвалериановой, αкетоизокапроновой, α-кетоизовалериановой (методом газовой хроматографии) в крови, моче; 4. Повышение уровня аллоизолейцина и α – гидроксиизовалериановой кислоты в крови, моче – патогномоничные биохимические маркеры; 5. Возможна ДНК – диагностика; 6. На МРТ признаки отека вещества головного мозга. Лечение 1. Адекватная диетотерапия (ограничение лейцина, изолейцина, валина до минимальных уровней, необходимых для поддержания нормального роста и развития) проводится специалистами под биохимическим контролем; 2. Назначение тиамина в дозе от 50 до 300 мг/день под клиническим и биохимическим контролем; 3. Лечение острых кризов: при первых признаках метаболического стресса отказ от пищи и переход на синтетические смеси под строгим биохимическим контролем содержания аминокислот и кетокислот с боковыми цепями в биологических жидкостях, перитонеальный и гемодиализ (для удаления токсических продуктов), инсулин (для минимизации катаболических процессов) на фоне введения углеводов. Исход лечения зависит от срока постановки диагноза (первые дни жизни) и адекватного биохимического контроля. Профилактика 1. Массовый скрининг новорожденных на гиперлейцинемию; 2. Пренатальная диагностика: определение активности дегидрогеназы αкетокислот с боковыми цепями в культуре амниоцитов, биоптате хориона; методы ДНК – диагностики; обнаружение аллоизолейцина в пуповинной крови (кордоцентез в конце 2 триместра беременности). Гомоцистинурия – аутосомно – рецессивное наследственное заболевание (ген картирован на 21q22.3), обусловленное нарушением метаболизма 14 серосодержащих аминокислот, что приводит к поражению органа зрения, скелета, патологии сосудов и нервной системы. В результате мутации гена для цистатионсинтетазы нарушается активность данного фермента, что сопровождается накоплением метионина, гомоцистина и его производных (гомоцистеина) в биологических жидкостях. Гомоцистеин повреждает сосудистую стенку, активируя выброс медиаторов воспаления. Также, являясь мощным коагулянтом, способствует отложению фибрина и тромбообразованию. Витамин В6 – кофактор цистатионсинтетазы. Некоторые из мутаций в гене приводят к нарушениям, которые могут быть скорректированы приемом пиридоксина. Различают 2 формы гомоцистинурии: пиридоксинзависимую (более половины всех случаев заболевания) и пиридоксинрезистентную. Классическая форма гомоцистинурии: дебют на первом году жизни симптомами поражения глаз (миопия), костной системы (плосковальгусные стопы, вальгусная деформация конечностей). В дальнейшем изменяется походка (напоминает походку Чарли Чаплина), задержка психоречевого (вплоть до умственной отсталости) и физического развития; характерны вывихи и подвывихи хрусталика, астигматизм высокой степени (к 8 – 10 годам) и другие офтальмологические нарушения (косоглазие, катаракта, глаукома, пигментная дегенерация сетчатки). У многих больных наблюдаются психиатрические проблемы: депрессия, шизофреноподобные расстройства, психозы. Характерны тромбозы, цереброваскулярные осложнения, эпилептические приступы. Дифференциальную диагностику проводят с синдромом Марфана. Диагностика 1. Повышение уровня гомоцистина и метионина в крови; 2. Скрининг – тест на присутствие гомоцистина в моче (качественный тест с нитропруссидом натрия). Лечение • при пиридоксинзависимой форме – лечение пиридоксином (активизирует фермент цистатионсинтетазу) в дозе 250 – 500 мг в сутки; • припиридоксинрезистентной форме – низкобелковая диета без метионина (полностью исключаются мясо, рыба, яйца, соя), используются лечебные диетические продукты (смеси незаменимых аминокислот); • Бетаин (Cystadane) – препарат, активизирующий альтернативный путь метаболизма гомоцистеина и позволяющий снизить его уровень в крови. Доза 6 г в сутки (детям старше 10 лет), 100 мг/кг в сутки (детям младше 10 лет). Профилактика Пренатальная диагностика проводится молекулярно – генетическими методами, если генотип пробанда известен. 15 Болезни углеводного обмена: 1. Галактоземия 2. Лактазная недостаточность 3. Фруктоземия 4. Гликогенозы Галактоземия Частота в популяции варьирует: от 1:667000 до 1:3800, в российских популяциях порядка 1:16242 Этиология Описана недостаточность трех ферментов, участвующих в метаболизме галактозы: 1. галактокиназа - GALK, 2. галактозо-1-фосфат-уридилтрансфераза - GALT, (почти 90% случаев галактоземии связаны с мутацией Q188R - заменой аргинина на глутамин в 188 положении). Примерно 46% больных – гомозиготы по этой мутации, а 40% – гетерозиготы . 3. уридиндифосфат-галактозо-4-эпимераза - GALE. Все эти состояния сопровождаются повышением уровня галактозы в крови (“галактоземией”), но для каждого типа ферментной недостаточности характерна самостоятельная и отличная от других вариантов клиническая картина. Классической галактоземией принято называть состояние, связанное с недостаточностью фермента галактозо-1-фостфат-уридил трансферазы (ГАЛТ), наследственный аутосомно-рецессивный дефект превращения галактозы в глюкозу. ГАЛТ катализирует перенос галактозо-1-фосфата в уридиндифосфат (УДФ)-глюкозу. В результате образуется УДФ-галактоза с высвобождением глюкозо-1-фосфата. При недостаточности ГАЛТ накапливается ее субстрат, галактозо-1-фосфат, а также галактоза, которая служит субстратом для предшествующего этапа метаболизма, когда галактозо-1-фосфат вырабатывается из галактозы посредством фосфорилирования из АТФ, катализируемого ферментом галактокиназой. Основным пищевым источником галактозы является молочный сахар лактоза (глюкоза и галактоза). Фрукты и овощи также содержат галактозу, но в гораздо меньших количествах. Третий фермент, УДФ-галактозо-4-эпимераза, отвечает за восстановление УДФ-глюкозы из УДФ-галактозы, то есть за создание субстрата для ГАЛТ. Клиническая картина: 1. Манифестация заболевания:обычно в неонатальном периоде 2. Клинические проявления в раннем неонатальном периоде: после нескольких кормлений женским молоком или его заменителями (молочными смесями) возникают трудности вскармливания, нарушение глотания, затянувшаяся желтуха, срыгивания, рвота, диарея, мышечная 16 гипотония, плохая прибавка в весе, развивается гепатомегалия с признаками печеночной недостаточности: гипербилирубинемия, гипогликемия, повышение активности трансаминаз и содержания в плазме аминокислот особенно фенилаланина, тирозина и метионина 3. Вторичные осложнения: спленомегалия, -нарушение свертывания крови, -картина геморрагического диатеза и гемолитической анемии, -симптомы почечной недостаточности - протеинурия, аминоацидурия, -гипотрофия, кахексия, -присоединение инфекции (в 90% Escherichia coli) приводит к сепсису и шоку -у 10-30% больных выявляется катаракта, при раннем начале терапии носит обратимый характер Лабораторная диагностика: 1. повышенные концентрации галактозы и/или галактозо-1-фосфата, 2. снижение содержания глюкозы и толерантности к ней, 3. повышение уровня общего билирубина, 4. повышение активности трансаминаз (АлТ и АсТ), 5. повышение содержания ионов хлоридов натрия, 6. снижение показателя рН 7. повышение содержания аминокислот в крови и моче преимущественно фенилаланина, тирозина, метионина 8. в моче: протеинурия, лейкоцитурия 9. ферментодиагностика эритроцитов, лейкоцитов или культуры кожных фибробластов- резкое снижение или отсутствие активности фермента GALT 10. Молекулярно-генетический анализ: поиск 6 частых мутаций (Q188R, S135L, K285N, L195P, Y209C, F171S), при отсутствии таковых и при полном клинико-биохимическом подтверждении диагноза- полное секвенирование гена GALT. Лечение Назначение диеты, ограничивающей поступление в организм лактозы. Прогноз При доброкачественном течении на фоне терапии формируется самоограничение в потреблении молока. Возможны отдаленные осложнения: задержка психомотрного развития, нарушение речи, овариальная дисфункция, неврологические и психические нарушения Безгалактозная диета пожизненно. Грудное молоко и молочные смеси заменяют на гидролизат казеина и соевое молоко. Рекомендуется проводить диетотерапию под контролем содержания галактозо – 1 – фосфата в эритроцитах. Беременным, ранее имевшим детей с галактоземией, рекомендуется соблюдение безгалактозной диеты. Введение безгалактозной диеты приводит к разрешению всех ранних проявлений, включая катаракты, и предупреждает их рецидивы. Учитывая 17 раннее разрешение органной дисфункции, можно было бы ожидать, что диетотерапия должна предотвратить отдаленные последствия метаболического дефекта. К сожалению эти ожидания не оправдываются, что, вероятно, связано со значительным эндогенным круговоротом галактозы, который не зависит от манипуляций на уровне диеты. Массовый скрининг новорожденных на галактоземию. Методология скрининга новорожденных на галактоземию проста, надежна и практична. Она основана на использовании высушенного пятна крови, в котором определяются или по отдельности или вместе уровни галактозы, галактозо-1-фосфата и активность ГАЛТ. Пренатальная диагностика Возможна путем определения активности GALT в культуре амниоцитов, биоптате и культуре хориона и по обнаружению галактитола (масс – спектрометрия) в амниотической жидкости, а также методами ДНК – анализа. Лактазная недостаточность Дефектый фермент: лактаза (дисахаридаза) расщепляет молочный сахар лактозу на глюкозу и галактозу. Тип наследования: АР. Частота в популяции варьирует: в Северной и Средней Европе 20% населения, Восточная и ЮгоВосточная Азия -75-100%. Клиническая картина: 1. Манифестация заболевания обычно в 3-13 лет, реже в периоде новорожденности; 2. Отмечается ощущение вздутия, урчание, переполнения живота; осмотическая диарея, проявляющаяся тяжелым водянистым поносом, возникающим через 30 минут – часов после приема молока или молочного продукта. Лечение Безлактозная диета, дополнительный прием кальция, заместительная терапия ( препараты- «тилактаза», «Лактаза-Беби»). Прогноз Благоприятный. Фруктоземия Альдолаза В (фруктозо-1-фосфатальдолаза) в норме осуществляет обратимое расщепление фруктозо-1-фосфата на D-глицеральдегид и дигидроксивацетонфосфат, накопление фруктозы и фруктозо-1-фосфата в организме вызывает гипогликемию а также острую или хроническую интоксикацию ЦНС и других органов. Тип наследования: АР. Различают две формы заболевания: инфантильную (проявляется обычно в первом полугодии в период введения в рацион фруктового пюре или сока) и 18 позднеинфантильную, характеризующуюся поздним началом (около 3-х лет) и более мягким хроническим течением. Клиническая картина 1. Рвота; 2. Отвращение к пище, содержащей фруктозу; 3. Гепатомегалия, желтуха; 4. Слабость, вялость; 5. Гипервозбудимость; 6. Судороги, обусловленные гипогликемией; 7. Гипотрофия, кахексия; 8. Спленомегалия; 9. Почечно-тубулярная дисфункция; 10. Мелена; 11. Генерализованный отек; Диагностика Лабораторные данные: фруктозурия, альбуминурия, аминоацидурия, гиперфруктоземия после нагрузки фруктозой, гипогликемия Лечение: Диета, не содержащая фруктозу и сахарозу, переливание плазмы. Прогноз При своевременно начатом лечении благоприятный, без лечения дети погибают от печеночной и/или почечной недостаточности. Гликогенозы - наследственные нарушения обмена веществ, обусловленные нарушением функции ферментов, принимающих участие в расщеплении гликогена. Выделяют следующие типы гликогенозов: Тип I – болезнь Гирке (10 клинических форм) Тип II – болезнь Помпе (3 клинические формы) Тип III – болезнь Кори (2 клинические формы) Тип IV – болезнь Андерсона Тип V – болезнь Мак-Ардла Тип VI – болезнь Герса Тип VII – болезнь Таруи Болезнь Гирке Этиопатогенез Глюкозо – 6 – фосфотаза катализирует конечную реакцию глюконеогенеза и гидролиз гликогена. Гидролиз глюкозо – 6 – фосфата на глюкозу и неорганический фосфат является единственным источником обеспечения организма большими концентрациями глюкозы. Поэтому, недостаточность 19 фермента ведет к гипогликемии даже при малейшем голодании из-за блокады гликогенолиза и накоплению гликогена в печени, почках и слизистой кишечника, приводя к дисфункции этих органов. Тип наследования: аутосомно – рецессивный. Клиническая картина: 1. Манифестация заболевания: обычно 3-4-й месяц жизни; 2. Большой живот, гепатомегалия, нефромегалия; 3. Гипогликемия, часто с судорогами; 4. Задержка роста; 5. Аденома печени, гепатома, карцинома печени; 6. Множественные ксантомы; 7. «Кукольное лицо»; 8. Метаболический ацидоз; 9. Подагрический артрит при хроническом течении; 10. Хроническая почечная недостаточность; 11. Легочная гипертензия; 12. Хроническая сердечная недостаточность. Болезнь Помпе (гликогеноз, тип II) Этиопатогенез В результате недостаточной активности лизосомной α – D – глюкозидазы, участвующей в гидролизе гликогена в мышцах и печени происходит отложению негидролизованного гликогена в лизосомах мышц – сердечной и скелетной («пенистые» клетки – при морфологическом исследовании), постепенно нарушая метаболизм мышечных клеток и приводя к их гибели, что сопровождается картиной прогрессирующей мышечной дистрофии. Наследование аутосомно – рецессивное (ген картирован на 17q23). Клиническая картина Различают: • раннеинфантильная форма: острое течение, с периода новорожденности плаксивость, снижение двигательной активности, прогрессирующая мышечная слабость, включая дыхательную мускулатуру, в дальнейшем задержка психомоторного развития, гипертрофия мышц при пальпации, макроглоссия, кардиомегалия (сначала гипертрофическая кардиомиопатия, которая прогрессирует в дилатационную), часто фиброэластоз эндокарда, гепатомегалия, диспноэ, легочно – сердечная недостаточность. Летальный исход до 1 года. • ювенильная форма: возраст начала заболевания от 3 до 10 лет, трудности при ходьбе, прогрессирующая мышечная дистрофия, висцеромегалия (кардиомегалия, гепатоспленомегалия), нормальный интеллект. Смерть от декомпенсированной сердечно – легочной недостаточности на 2 – ом десятилетии. • взрослая форма: возраст начала заболевания 2 – 3 – е десятилетие, манифестирует как миопатия с медленно прогрессирующей слабостью 20 проксимальных отделов нижних конечностей, сколиоз грудного отдела, лордоз, крыловидные лопатки. Не бывает висцеромегалии. Доживают до старости. Диагностика 1. Снижение активности кислой α - D – глюкозидазы в лейкоцитах, культуре кожных фибробластов; 2. На ЭКГ регистрируется укороченный интервал P – R нередко в сочетании с высоким вольтажом комплексов QRS, что типично для этого заболевания и позволяет отличить его от других кардиомиопатий; 3. Значительное повышение креатинфосфокиназы сыворотки крови; 4. Не выявляется гипогликемия; 5. На рентгенографии грудной клетки – кардиомегалия; 6. Биопсия мышц, печени: гликоген повышен. Лечение 1. Симптоматическая терапия. 2. Ферментная заместительная терапия: препарат Миозим (США), представляющий собой рекомбинантную кислую α – глюкозидазу, вводится внутривенно для восполнения недостаточности фермента. Пренатальная диагностика Возможно проведение пренатальной диагностики биохимическими методами или методами ДНК анализа, если генотип пробанда известен. Лизосомные болезни накопления – редкие наследственные заболевания. Известно 45 различных форм лизосомных болезней накопления (ЛБН). Клинические проявления разнообразны – от ранних форм, манифестирующих водянкой плода, до легких, доброкачественных заболеваний, проявляющихся на 5 – 6 десятилетии и существенно не влияющих на качество и продолжительность жизни. Молекулярные механизмы этиопатогенеза ЛБН сходны. Все они обусловлены мутациями генов, контролирующих процесс внутрилизосомного гидролиза таких макромолекул, как гликозаминогликаны, гликолипиды, гликопротеины. Мутации соответствующих генов могут нарушать синтез, созревание или транспорт самих лизосомных ферментов, белков – активаторов или белков, контролирующих транспорт субстратов, подлежащих гидролизу. Достижения последних лет привели к созданию эффективных методов метаболической коррекции ЛБН. Прежде всего, это ферментная заместительная терапия, а также терапия с ограничением синтеза субстрата, фармакологические шапероны и трансплантация гемопоэтических стволовых клеток. 21 Классификация ЛБН 1. Липидозы: - сфинголипидозы: гликосфинголипидозы (болезнь Фабри, болезнь Гоше, GМ1 - ганглиозидоз, GМ2 – ганглиозидоз (болезнь Тея – Сакса), лейкодистрофии (болезнь Краббе, метахроматическая лейкодистрофия) и другие (болезнь Ниманна – Пика, болезнь Фарбера); - другие болезни накопления: болезнь Вольмана, болезнь накопления эфирохолестерина. 2. Мукополисахаридозы (выделяют Гурлер синдром, Шейе синдром, Гурлер – Шейе синдром, Санфиллипо А синдром, Санфиллипо В синдром, Санфиллипо С синдром, Санфиллипо Д синдром, Моркио А синдром, Моркио В синдром, Марото – Лами синдром, Слая синдром, МПС 1Х типа; 3. Гликогенозы (болезнь Помпе, болезнь Данон); 4. Гликопротеинозы (фукозидоз, сиалидоз, болезнь Шиндлера, аспартилглюкозаминурия, галактосиалидоз, альфа – маннозодоз); 5. Муколипидозы; 6. Нейрональные цероидные липофусцинозы 7. Другие ЛБН (цистиноз, болезнь Сала, множественная сульфатазная недостаточность). Липидозы - наследственные нарушения обмена веществ, обусловленные снижением активности ферментов, что приводит к накоплению липидов (глюкоцереброзидов, сфинголипидов и др.) в клетках ретикулоэндотелиальной, нервной систем. Болезнь Гоше (гликосфинголипидоз) – аутосомно – рецессивное заболевание (ген картирован на хромосоме 1q21), возникает в результате недостаточности фермента β – D – глюкоцереброзидазы, что приводит к накоплению глюкоцереброзидов и сфинголипидов в клетках ретикулоэндотелиальной, нервной систем. Число и размер лизосом увеличиваются, приводя к гибели клеток. Гистохимически это проявляется «пенистыми» клетками в РЭС селезенки, костного мозга, лимфоузлов, печени, плаценты, головного мозга. При болезни Гоше происходит дегенерация нейронов в базальных ганглиях, в теменных и затылочных долях коры полушарий большого мозга. Клиническая картина Различают 3 формы заболевания: • болезнь Гоше тип 1, хроническая без поражения нервной системы: манифестирует в возрасте от 5 до 80 лет; медленное прогрессирование; доминирует в клинике гепатоспленомегалия, остеопеническая и остеолитическая дегенерация скелета); • болезнь Гоше тип II, острая нейропатическая (быстрое и злокачественное течение): с первых месяцев жизни – задержка физического, психического развития, гепатоспленомегалия; разнообразная неврологическая симптоматика – прогрессирующие психомоторные расстройства, судороги, гиперрефлексия, 22 бульбарно – псевдобульбарный синдром; летальный исход на первом году жизни; • болезнь Гоше тип III, подострая нейропатическая: дебют заболевания с раннего возраста до второго десятилетия гепатоспленомегалией, неврологическими расстройствами; нередки проявления геморрагического диатеза, носовые и кишечные кровотечения; медленное прогрессирование. Диагностика Определение активности глюкоцереброзидазы в лейкоцитах, культуре кожных фибробластов, методы ДНК анализа. Снижение активности фермента менее 25 % нормального уровня подтверждает диагноз. Лечение Для типа 1 применяется ферментативная заместительная терапия – препарат Церезим (США). Назначается 1 раз в 2 недели внутривенно капельно, медленно. Терапия проводится пожизненно. Другим подходом к лечению может быть использование субстратредуцирующей терапии – препарат «Завеска» (миглустат, Швейцария). Данный препарат ингибирует гликозилцерамидсинтазу – фермент, который катализирует первую стадию синтеза гликосфинголипидов и тем самым может препятствовать их накоплению. Назначается перорально (начальная доза у взрослых 100 мг 3 раза в сутки), пожизненно. Методы эффективной терапии для типа II не разработаны. Профилактика Возможно проведение пренатальной диагностики биохимическими методами или методами ДНК анализа, если генотип пробанда известен. Болезнь Ниманна – Пика (сфинголипидоз) – аутосомно – рецессивное заболевание (ген картирован на хромосоме 11р15.4 – 15.1), возникающее в результате недостаточной активности фермента сфингомиелиназы, что приводит к накоплению сфингомиелина в клетках ретикулоэндотелиальной, нервной систем. Клинически выделяют следующие типы болезни Ниманна – Пика: • болезнь Ниманна – Пика тип А: дебют на первом году жизни – затянувшаяся желтуха, увеличенный в объеме живот, нарушения вскармливания, рвота, диарея, гипертермия; в дальнейшем гепатоспленомегалия, диффузные инфильтраты в легких, задержка психоречевого развития, мышечная гипотония или ригидность с постепенной утратой ранее приобретенных двигательных и психомоторных навыков; дегенерация макулы по типу «вишневой косточки» (у 50 %); неблагоприятный исход до 3 лет; • болезнь Ниманна – Пика тип В: манифестирует в более позднем возрасте; гепатоспленомегалия, диффузные инфильтраты в легких, дегенерация макулы по типу «вишневой косточки». 23 Диагностика Характерны микроцитарная анемия, тромбоцитопения, «пенистые» клетки в пунктате костного мозга и печени. Снижение активности сфингомиелиназы в лейкоцитах, культуре кожных фибробластов. Методы ДНК анализа. Лечение Возможно проведение трансплантации гемопоэтических стволовых клеток при отсутствии поражения нервной системы. При успешном приживлении гемопоэтических стволовых клеток повышается активность фермента сфингомиелиназы, улучшаются показатели крови и уменьшаются в размерах внутренние органы. Профилактика Возможно проведение пренатальной диагностики биохимическими методами или методами ДНК анализа, если генотип пробанда известен. Мукополисахаридозы – наследственные нарушения обмена веществ, обусловленные нарушением функции ферментов, принимающих участие в деградации гликозаминогликанов (ГАГ). Суммарная частота мукополисахаридозов (МПС) достигает 1:29000 живых новорожденных. Различают 10 различных типов МПС. Каждый из них обусловлен недостаточностью одного из лизосомных ферментов, принимающих участие в каскадных реакциях расщепления ГАГ. Накопление частично деградированных ГАГ в лизосомах приводит к постепенной гибели клеток и тканей и дисфункции органов. Согласно их фенотипическим проявлениям МПС можно разделить на 2 группы: МПС с Гурлер – подобным фенотипом (МПС 1, МПС II, МПС III, МПС IV и МПС VII) и МПС с Моркио – подобным фенотипом (МПС IV и МПС IV В). Все МПС, кроме МПС II, являющегося Х – сцепленным заболеванием, наследуются по аутосомно – рецессивному типу. Для всех типов МПС характерны общие клинические проявления, обусловленные накоплением ГАГ в различных тканях: 1. Мультисистемность поражения; 2. Специфические особенности фенотипа: характерные изменения черт лица по типу гаргоилизма (грубые черты лица); 3. Скелетные деформации по типу множественного дизостоза (тугоподвижность мелких и крупных суставов); 4. Гепатоспленомегалия; 5. Нейросенсорная тугоухость; 6. Сердечно – сосудистые нарушения; 7. Различные неврологические нарушения (снижение интеллекта, задержка речевого развития, изменение мышечного тонуса, сухожильных рефлексов и др.); 24 8. Изменения кожи и придатков (сухость, уплотнение кожных покровов со снижением их эластичности, гиперпигментация в области дистальных отделов кистей рук, склеродермоподобные изменения, гипертрихоз, очаговая алопеция, депигментированные участки волос, жесткие волосы); 9. Частые инфекционные заболевания ВДП, обструктивный синдром, апноэ во время сна; 10. Прогрессирующие когнитивные нарушения. Диагностика. Клинический полиморфизм характерен для многих ЛБН, в том числе и для МПС. Это затрудняет дифференциальную диагностику этих болезней на клиническом уровне, и для точного установления диагноза требуется проведение лабораторных методов исследования, основанных на использовании биохимических тестов – исследование спектра и количества экскретируемых ГАГ, определение активности лизосомных ферментов и ДНК – диагностики. Лечение. Симптоматическая терапия: антибиотики, слухопротезирование, хирургическое лечение, сердечные препараты и др. Специфическая ферментная заместительная терапия (ФЗТ). В настоящее время созданы препараты для ФЗТ: МПС 1 – «Альдуразим», США; МПС 11 – «Элапраза», США; МПС V1 – «Наглазим», США. Для других МПС пока не разработано специфического лечения. Трансплантация гемопоэтических стволовых клеток (применяются как клетки костного мозга, так и пуповинной крови) – может корректировать недостаточность фермента. Профилактика В отягощенных семьях возможно проведение пренатальной диагностики биохимическими методами – определение активности лизосомных ферментов в ворсинах хориона или методами ДНК анализа. При болезни Хантера (Х – сцепленное наследование) обследование родственников по материнской линии для выявления носительниц данного заболевания. Пероксисомные болезни - группа заболеваний, обусловленных нарушением структуры и функции пероксисом (внутриклеточных органелл, присутствующих в каждой клетке организма за исключением зрелых эритроцитов). Ферментная система пероксисом выполняет следующие функции: 1. β – окисление очень длинноцепочечных жирных кислот (ОДЦЖК), дикарбоновых кислот, пипеколиновой кислоты, простагландинов; 2. Начальные этапы биосинтеза плазмалогенов, входящих в структуру миелина и составляющих 5% - 20% фосфолипидов клеточных мембран; 25 3. Детоксикация перекиси водорода, зашита клетки от образующегося в ней атомарного кислорода с помощью химических превращений, в которых участвуют пероксисомные каталазы; 4. Превращение субстратов в холевую и дезоксихолевую кислоты, α – окисление фитановой кислоты в пристановую кислоту. Этиопатогенез В сборке зрелой, функциональной пероксисомы принимает участие группа белков – пероксинов, которые участвуют в импорте белков в пироксисомы, биогенезе пероксисомных мембран и делении этих органелл. Известно 32 пероксина. Мутации генов РЕХ3, РЕХ16, РЕХ19 приводят к полному отсутствие пероксисом и пероксисомных мембран. При мутации генов РЕХ1, РЕХ6, РЕХ4, РЕХ13, РЕХ14, отсутствуют только белки пероксисомного матрика, а в культуре клеток находят измененные пероксисомы («пероксисомы – призраки»). Группа болезней, связанных с нарушение биогенеза пероксисом (их полное отсутствие или нарушение их функциональной активности) включает 4 клинических фенотипа: синдром Цельвегера, неонатальную адренолейкодистрофию, младенческую форму синдрома Рефсума и ризомелическую точечную остеохондродисплазию. Синдром Цельвегера - это группа генетически гетерогенных состояний. К клиническим проявлениям синдрома Цельвегера могут приводить мутации в генах пероксинов 1,2,3,5,6 и 12. Все варианты синдрома Цельвегера наследуются по аутосомно-рецессивному типу. Клиническая картина 1. Первые симптомы отмечаются с рождения; 2. Для больных характерна внутриутробная гипотрофия (вес при рождении не превышает 2500 г), дисморфизм в строении лица и черепа — увеличение размеров лба, монголоидный разрез глаз, периорбитальная полнота тканей, короткий вздернутый нос, микрогнатия; 3. Среди наиболее типичных признаков: резкая мышечная гипотония, доходящая до атонии, и поликистоз почек; 4. У всех больных отмечаются полиморфные пороки развития головного мозга. Часто диагностируется полимикрогирия, лизэнцефалия, агенезия мозолистого тела, очаги демиелинизации в белом веществе мозга, гидроцефалия; 5. В ряде случаев выявляется патология глаз в виде врожденных катаракт и глауком, а также пороки сердца и наружных половых органов; 6. Для заболевания характерна длительная желтуха и симптомы надпочечниковой недостаточности в первые месяцы жизни. У всех детей отмечается грубая задержка раннего психомоторного развития и снижение продолжительности жизни; 7. Большинство больных погибает в течение первого года. 26 Адренолейкодистрофия При заболевании страдает белое вещество мозга. Клиническая картина классической адренолейкодистрофия (тип наследования Х-сцепленный, рецессивный) 1. Болеют обычно мальчики; 2. Первые симптомы обнаруживаются в возрасте 5-12 лет жизни (нарушение поведения, недостаток внимания, снижение памяти); 3. По мере прогрессирования присоединяются деменция, потеря зрения изза атрофии зрительных нервов, пирамидные нарушения. Отмечаются бульбарные и псевдобульбарные расстройства, сенсорная глухота. 4. Появляются признаки адреналовой недостаточности (общая слабость, рвота, гиперпигментация кожи). Митохондриальные болезни – состояния, связанные с нарушениями дыхательной цепи МТ. Суммарная частота МБ составляет от 1:5000 – 1:10000 живых новорожденных. Этиопатогенез В митохондриях (крупные органеллы клеток) протекает огромное число биохимических процессов, направленных на выработку биохимической энергии: окисление жирных кислот, окислительное фосфорилирование, включающее дыхательную цепь МТ. Болезни дыхательной цепи МТ обусловлены нарушениями пяти ферментных комплексов дыхательной цепи МТ, которые обеспечивают заключительный этап клеточного дыхания и синтез АТФ. В состав комплексов дыхательной цепи МТ входит более 80 различных полипептидов, основное количество которых кодируется ядерной ДНК. Митохондриальная ДНК кодирует 13 субъединиц комплексов дыхательной цепи МТ , а также РНК, необходимые для синтеза белка в МТ. Заболевания, связанные с мутациями в ядерных генах, наследуются по таким же принципам, как и другие болезни. Болезни, обусловленные мутациями мтДНК, имеют свои особенности клинических проявлений, наследования и диагностики, которые связаны с уникальными свойствами мтДНК. Клинические фенотипы весьма разнообразны: болезни дыхательной цепи митохондрий (БДЦМ) могут дебютировать в любом возрасте и проявляться патологией любой системы органов. Наиболее часто поражаются мышечная, нервная и эндокринная системы, что отражает закономерность в потребности тканей в энергии окислительного фосфорилирования. Выделяют несколько синдромов БДЦМ, для которых характерно сочетание клинических симптомов и связи с определенными мутациями мтДНК: 1. MELAS – митохондриальная энцефалопатия, лактат – ацидоз, инсультоподобные приступы; 2. MERRF – миоклонус – эпилепсия, наличие «рваных» красных волокон в мышечном биоптате; 3. LHON – атрофия зрительных нервов Лебера; 27 4. KSS – синдром Кернса – Сейра (классическая клиническая картина описывается триадой симптомов: манифестация до 20 лет, прогрессирующая офтальмоплегия, пигментная дегенерация сетчатки); 5. CPEO – прогрессирующая наружная офтальмоплегия; 6. LS - синдром ЛИ (дебютирует в раннем детском возрасте, характеризуется прогрессирующими неврологическими расстройствами (утратой ранее приобретенных психомоторных навыков, мышечной гипотонией, мозжечковыми и экстрапирамидными расстройствами, судорогами), лактат – ацидозом и характерными изменениями при МРТ головного мозга; 7. NARP – невропатия, атаксия, пигментная дегенерация сетчатки. Эти клинические синдромы могут перекрываться друг с другом, представлять комбинацию из 2 и даже 3 клинических фенотипов. Некоторые из них, по мере прогрессирования болезни, могут переходить один в другой. Диагностика 1. Определение концентрации лактата и кетоновых тел в крови до и после пищевой нагрузки, так как при расстройствах окислительного фосфорилирования происходит увеличение лактата и кетоновых тел. 2. Определение активности комплексов дыхательной цепи митохондрий в мышечном биоптате, лейкоцитах. Этапы диагностики НБО 1. Стандартные скрининговые тесты 2. Количественные исследования 3. Нагрузочные пробы 4. Исследования вовлеченности в патологический процесс органов и систем 5. Исследования активности ферментов 6. ДНК-диагностика В настоящее время выявлены генетические факторы предрасположенности к атеросклерозу в детском и подростковом возрасте. Выделяют наследственные формы гиперлипопротеидемий (ГЛП), для которых характерно раннее развитие ишемической болезни сердца (ИБС) и ранних форм атеросклероза. Классификация гиперлипопротеидемий (ГЛП) (по Фредриксону): выделяют ряд семейных форм болезни: 1, 11А, 11Б, 111, 1V, V типы. Они характеризуются различными соотношениями содержания ХС, его фракций и уровня триглицеридов (ТГ). 1 тип ГЛП (встречается редко) Отсутствие иди дефицит липопротеидлипазы приводит к нарушению лизиса хиломикронов и ХС в капиллярах жировой ткани и мышцах. Диагностика: снижение уровня липопротеидлипазы, выраженная ГЛП, гепатолиенальный синдром, панкреатит, в сыворотке значительное увеличение ТГ. 28 Тип 11А ГЛП – наиболее часто встречаемый. Биохимические проявления: повышение уровня ЛПНП и ХС. Клинические проявления: ксантомы, преждевременное развитие ИБС и атеросклероза. Причина: патология рецепторного аппарата ЛПНП, расположенного на поверхности цитоплазматической мембраны клеток, обусловленная следующими мутациями гена: 1. Полностью отсутствует рецепторный белок (нулевые аллели); 2. Синтезируется дефектный белок, имеющий замедленный транспорт к мембране клеток и преждевременно разрушающийся в эндоплазматическом ретикулуме клетки; 3. Синтезируется рецептор ЛПНП с пониженной способностью связывать ЛПНП; 4. Образуется дефектный рецептор, препятствующий поступлению внутрь клетки связанных ЛПНП; 5. Образуется дефектный белок рецептора, при котором происходит ускоренная деградация самого рецептора. В 2004 г. была описана у детей и подростков мутация Е207К в гене синтеза рецепторного белка ЛПНП. Кроме аномалий ЛПНП – рецепторного аппарата выявлены мутации самого апопротеина В, входящего в состав белковой части ЛПНП (расположен на 2 хромосоме). Такой ЛПНП, в состав которого входит дефектный апо – В – белок, не способен связываться с рецептором, и в результате развивается гиперХСемия. Встречаются как гомозиготные (1:1000000), так и гетерозиготные формы (1:200 – 500). Клинически у гетерозигот отмечается умеренная гиперхолестеринемия, увеличение фракции ЛПНП, ксантоматоз сухожилий, инфаркт миокарда, который может развиться в возрасте 35 – 45 лет. Наиболее тяжелая гомозиготная форма, протекающая с выраженной гиперХСемией и высоким уровнем ЛПНП, отложением липидов в коже, сухожилиях, роговице, характеризуется развитием ИБС уже до 20 лет. ГЛП типа 11Б клинически сходна с ГЛП 11А типа, но сопровождается гипертриглицеридемией и непереносимостью глюкозы. Семейная ГЛП типа 111 - аутосомно – рецессивное или доминантное наследование: 1. Повышенный уровень ХС, ТГ; 2. Повышенный уровень ЛПОНП, вследствие замедленного распада аномальных ЛПНП (дефект сопряжен с мутацией не только апопротеина В, но и апопротеина Е, входящего в состав белковой структуры ЛПОНП, которые являются ведущей транспортной формой эндогенных ТГ). 3. Характерна лабильность показателей ХС и ТГ плазмы крови при ограничении углеводов в пищевом рационе. 4. Частые спутники – ожирение, СД, подагра. 29 5. Проявляется в подростковом возрасте, сопровождается ксантомами в области ягодиц, в складках суставов, ладоней, в интиме периферических и коронарных сосудов. Семейная ГЛП 1V типа - высокая частота встречаемости (1:100): 1. Аутосомно – доминантный тип наследования, гетерозиготная форма (гомозиготы не обнаружены). 2. Умеренно высокое содержание ТГ и избыток ЛПОНП на фоне нормальных или слегка повышенных значений ХС; 3. ИР и ожирение. 4. Чаще является основой формирования МС, часто сопровождается гиперурикемией, ранним атеросклерозом, ксантоматозом, панкреатитом, АГ, СД 2 типа. ГЛП типа V практически не встречается в детской и подростковой популяции Описанные моногенные формы ГЛП должны привлекать внимание врачей ввиду того, что для них характерно раннее начало, сочетание с ожирением и гиперинсулинемией, клинические проявления в виде ксантоматоза, не всегда распознаваемого в детстве, а также отягощенная наследственность по раннему развитию атеросклероза. В настоящее время известно более 20 генов, которые определяют процессы, оказывающие влияние на регуляцию энергетического гомеостаза организма и участвующие в генезе избыточной массы тела и ожирения. В большинстве случаев детского ожирения отмечается многофакторность этого заболевания. «Гены – кандидаты» повышают риск возникновения избыточной массы тела у ребенка только при условии действия средовых факторов (питание и образ жизни). 30 Литература: 1. Генетический паспорт – основа индивидуальной и предиктивной медицины /Под ред. В.С. Баранова. – СПб.: Изд – во Н-Л, 2009. – 528 с. 2. Краснопольская К .Д . Наследственные болезни обмена веществ. Справочное пособие для врачей. - М., 2005, 364 с. 3. Михайлова С.В., Захарова Е.Ю., Петрухин А.С. Нейрометаболические заболевания у детей и подростков.- М.: Литтерра. _ 2011. – 352 с. 4. Генетика человека с основами общей генетики: учебное пособие/ Н.А. Курчанов. – 2 – е изд., перераб. И доп. – СПб.: СпецЛит, 2009. – 191 с. 31 Чупак Э.Л., Бабцева А.Ф. Наследственные болезни обмена веществ: учебное пособие, Благовещенск: Буквица, 2012. - 31 с. Отпечатано в типографии «Буквица», 2012 г. 675000, Амурская область, ул. Б. Хмельницкого, 9 Тел./факс: (4162)531510,тел. 49-12-70, 53-14-69 Е-mail: info@bukvica.com www.bukvica.com 32 33
Наследственные болезни обмена веществ развиваются вследствие дефицита того или иного фермента, участвующего в обмене аминокислот.
- Наследственные нарушения обмена включают в себя большую группу Для наследственных болезней обмена веществ иногда используется.
- О.С. Наследственные болезни обмена веществ – один из обширных классов наследственных моногенных заболеваний человека. Данное пособие.
- Узнайте какую опасность таит Наследственные болезни обмена веществ.
- Наследственные болезни обмена веществ у новорожденных - описание и стоимость анализов в независимой медицинской лаборатории Инвитро.
НАСЛЕДСТВЕННЫЕ БОЛЕЗНИ ОБМЕНА ВЕЩЕСТВ
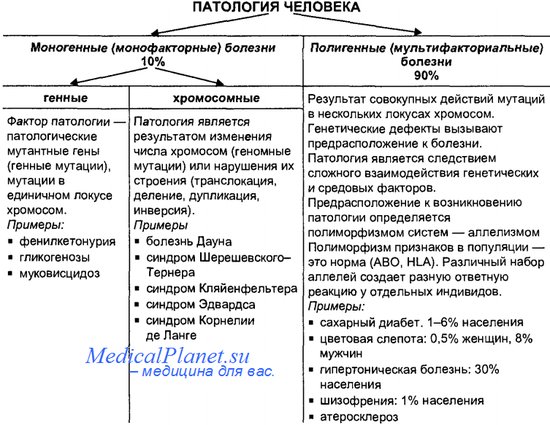
Общие принципы лабораторной диагностики наследственных болезней обмена веществ. На клиническом уровне диагноз НБО может быть только.
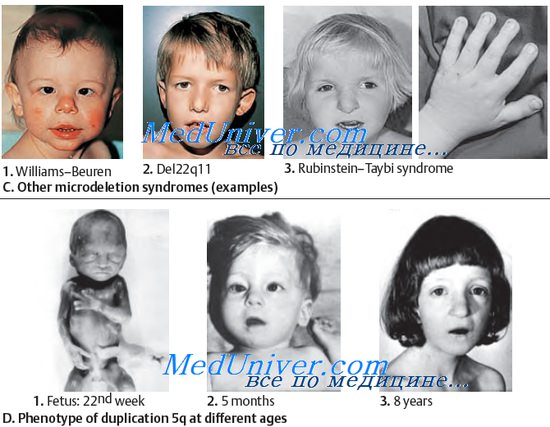


Среди наследственных заболеваний человека одно из самых значительных мест занимают наследственные болезни обмена. Большая часть.
